首个国产HPV疫苗上市,江苏疾控助力疫苗“中国创造”
2019年最后一天,由厦门大学夏宁邵团队和厦门万泰共同研发的国内首个双价人乳头瘤病毒疫苗(HPV疫苗)获国家药品监督管理局批准上市。首个国产2价HPV疫苗的上市将打破外资药企垄断的局面,也意味着中国由此成为全球继美英后第三个成功研发生产HPV疫苗的国家。

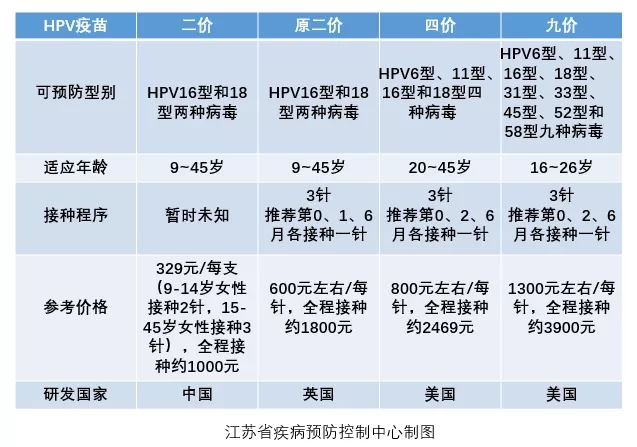
该产品由厦门大学夏宁邵团队和厦门万泰共同研发,是首个获批的国产人乳头瘤病毒疫苗,针对HPV16、18型HPV病毒,属2价HPV疫苗,适用于9-45岁女性。据了解,馨可宁的定价为329元/支,9-14岁女性只需要接种2针,15-45岁女性接种3针。
而此前,国内已上市的HPV疫苗均为进口疫苗。九价HPV疫苗价格约为1300元/针,四价HPV疫苗价格约为800元/针,二价HPV疫苗约为600元/针,对应的全部接种费用分别为4000元、2400元和1800元左右。相比之下,国产HPV疫苗更具价格优势,对于在全国乃至世界范围内普及HPV疫苗接种具有积极意义。
事实上,为了研发一支具有完全自主知识产权的HPV疫苗,这支国产2价HPV疫苗背后经历了18年的研究与开发。江苏省疾控中心朱凤才团队作为磬可宁上市前临床评价的主要力量,功不可没。推进新型疫苗迈向“中国创造”的军功章,也有咱江苏疾控的一份。
据江苏省疾控中心副主任朱凤才介绍,从2010年12月Ⅰ期临床试验第1例受试者入组,到2019年10月由7372位女性参与的大规模Ⅲ期临床试验终期分析,这支国产2价HPV疫苗大约持续进行了10年的上市前临床评价。江苏有4家县、区疾控中心参与国产HPV疫苗的上市前评价。江苏省疾控中心更是Ⅰ期、Ⅱ期临床试验的负责单位,是Ⅲ期临床试验的主要参与单位。
2002年,HPV疫苗研发团队立项研发。
2007年,研发团队申报临床试验。
2010年和2011年,江苏省东台市疾控中心作为现场单位,先后承担并高质量完成了磬可宁上市前评价的Ⅰ期、Ⅱ期临床试验,为后续评价工作的开展提供了有效的数据支撑。
2012年,江苏省阜宁县疾控中心作为现场单位,承担了磬可宁上市前评价的Ⅲ期临床试验,历时14天,顺利完成了2100余例受试者的入组工作。经过漫长的7年随访,数十名研究者无数次的南下与北上,圆满完成了全部访视任务。
2015年,江苏省射阳县疾控中心作为现场单位,承担了磬可宁上市前评价9-17岁女性人群的桥接试验,证实了在9-14岁女性人群接种两针次该疫苗的有效性。
2017年11月,二价HPV疫苗启动上市申报。
2019年12月31日,首个国产HPV疫苗获批上市!多年的翘首以盼后,国人终于迎来真正的国产宫颈癌疫苗。